La combustión
La combustión
Categoría: Pandilla Petit, (preescolar y 1ro. y 2do. año de primaria)
Área de participación: Ciencias Exactas y Naturales
Resumen
La combustión es un fenómeno químico, y sucede cuando un elemento combustible se combina con el oxigeno que hay en el aire, por lo que haremos un pequeño experimento para ver sin podemos realizar la combustión o que obtendremos de este proceso .
Pregunta de Investigación
¿Qué importancia tiene la combustión en la gente común?Planteamiento del Problema
Aunque hoy en día el proceso de combustión esta bien entendido ha sido uno de los grandes enigmas desde los tiempos antiguos hasta finales del siglo XVIII.
Ya sea que usted quiera volar alrededor del mundo, manejar su automóvil para ir de compras o simplemente calentarse en la casa previamente tiene que iniciar el fuego. Sin embargo lograr la mejor combustión no es fácil.
Por lo que considero seguir estudiándolo para saber como eliminar la contaminación que el combustible produce.
Antecedentes
De acuerdo con el pensamiento griego todo aquello que puede arder contiene lo que denominaban el elemento fuego. Fue el químico y físico alemán Georg Ernest Stahl (1660- 1734), quien, recogiendo una idea de J. J. Becher, propuso en 1702 el nombre de flogisto (del griego phlogistos, que significa inflamable) para caracterizar el principio de inflamabilidad.
La teoría de la combustión de Stahl establecía que cuanto más flogisto tenía una sustancia más combustible era. Así, por ejemplo, un papel arde porque contiene flogisto, sin embargo sus cenizas desprovistas de dicha sustancia no pueden arder. En este esquema la combustión de una sustancia suponía la perdida de flogisto que se transfería al aire. Cuanto más flogisto tuviese una sustancia mejor ardía.
La teoría del flogisto ganaba adeptos y hacia mediados del siglo XVIII era ampliamente aceptada por los químicos, sin embargo había una dificultad que tanto Stahl como sus discípulos no pudieron explicar. La combustión de la madera, con la subsiguiente perdida de flogisto, producía en cenizas de peso inferior a aquella; Sin embargo, la calcinación hoy podríamos decir la oxidación de los metales dando lugar a la formación de la correspondiente cal ,que análogamente Stahl interpretaba como una perdida de flogisto resultaba en un aumento de peso. ¿Había entonces dos tipos de flogisto: el de la madera y sustancias afines, cuyo peso era positivo, y el de los metales, cuyo peso era negativo? Como veremos más adelante, fue Lavoisier, el padre de laQuímica Moderna, quien demostró que la teoría del flogisto no era verdadera y que el flogisto no existía.
El desarrollo de la química neumática del siglo XVIII supuso una oportunidad para comprobar la validez de la teoría del flogisto al investigar los gases producidos en la combustión.
Las inconsistencias en la teoría del flogisto y los numerosos descubrimientos basados en la experimentación con gases fueron correctamente explicadas y reunidos en una nueva visión global del fenómeno de la combustión gracias al trabajo de Antoine Laurent Lavoisier. No cabe duda de que el éxito de Lavoisier se debió a sus grandes dotes intelectuales pero especialmente a su habilidad y rigor experimental basado en la medida precisa de los datos experimentales.
Lavoisier explicó el fenómeno de la combustión, el gran problema de la Química del Siglo XVIII.
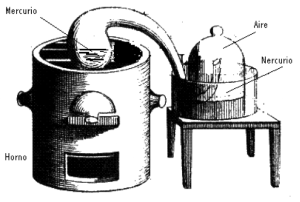
Un experimento típico realizado por Lavoisier consistió en calentar metales (por ejemplo, plomo) en el aíre pero en un recipiente cerrado. Lavoisier observaba que en la superficie del metal se iba formando una capa de calcinado hasta que en un instante dado la formación de dicho calcinado se detenía.Para Lavoisier resultaba claro que si el metal había ganado peso y el peso total no había cambiado, el aíre tendría que haber perdido una cantidad de peso equivalente al ganado por el metal. Así, abrió el recipiente y observó que el aíre entraba en el, debido a que la perdida del aíre durante el proceso de calcinación del metal había producido un cierto vacío, una presión inferior frente a la presión atmosférica. Para Lavoisier estaba claro que la calcinación de un metal no consistía en una pérdida de su flogisto sino en la ganancia de una parte del aíre en cuyo seno se calentaba.
Para Lavoisier el aíre era una mezcla de dos gases en una proporción de 1 a 4, uno respirable que mantiene la respiración y combustión, y otro “mefítico” incapaz de mantener dichos procesos, y que no es otro que el gas nitrógeno. Solo esta porción del aíre se combina con los materiales durante el proceso de combustión.
El experimento clave de Lavoisier, presentado en 1777 en la Academia de Ciencias de Francia, consistió en primer lugar en calentar cuidadosamente mercurio puro en aíre común y formar el mercurio calcinado demostrando que dicho mercurio calcinado es meramente una combinación del mercurio con aproximadamente 1/12 parte de su peso de aíre. En este proceso según Lavoisier el mercurio había absorbido la parte mejor y más respirable del aíre quedando la parte mefítica o irrespirable. En segundo lugar –y esta fue una parte clave del experimento- Lavoisier recuperó el aíre ‘absorbido´ por el mercurio, por calentamiento del calcinado, y lo devolvió al residuo mefítico, obteniendo prácticamente la cantidad original del aíre usado y con las mismas propiedades del aíre común.
Lavoisier llamó a este aíre vivo, el “aíre desflogÍsticado” oxígeno derivado delgriego, que significa productor de ácidos ya que Lavoisier pensaba que este elemento era un compuesto necesario de todos los ácidos, lo cual se demostró posteriormente no ser cierto.
En cualquier caso y al margen de la naturaleza de los ácidos, la contribución extraordinaria de Lavoisier fue establecer inequívocamente que el principio de la combustión de una sustancia consiste en una reacción química de dicha sustancia y el oxígeno.
Objetivo
Difundir a la comunidad que la combustión es un proceso muy importante en nuestras vidas pues los combustible se usan como fuente de energía, gasolina, gas etc.
Justificación
Ver en este proceso que es lo que ocurría al subir el agua o al apagarse la vela y ver la manera de no producir demasiado dióxido de carbono que es un gran contaminante del medio ambiente.
Hipótesis
Si doy a conocer el proceso de la combustión a la comunidad, entonces comprenderán por que es tan importante en la vida diaria.
Método (materiales y procedimiento)
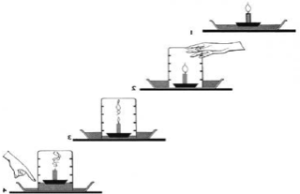
En el fenómeno de la combustión necesitamos los siguientes materiales :
• vela
* caja de cerillos
* plato
• 150 ml de agua
El procedimiento es muy simple:
1.-pegar al fondo del plato la vela,
podemos utilizar la misma cera
caliente para hacer esto.
2.- Agregar agua en el plato.
3.-Utilizando el cerillo prender la vela
con mucho cuidado.
4.- Colocar el vaso cubriendo la
vela de forma rapida.
5.-Observar cuidadosamente como se
comporta el agua que esta contenida
en el plato
Si hiciste el experimento con cuidado, pudiste observar lo siguiente, una vez que prendiste la vela, pudiste ver una flama, producto de la combustión de la vela, esto produce calor, el cual puedes sentir, se produce luz el cual puedes ver a simple vista y adema pudiste observar como se desprende un humo, el cual entre otras cosas es bióxido de carbono y vapor de agua, cuando pones el vaso cubriendo la vela, empezó a hacerse más pequeña, dentro del vaso pudiste observar que lo humos se hacen muy evidentes y además pudiste ver como el agua comenzó a subir de nivel original a un nivel mas alto por el vaso.
Galería Método
Resultados
Discusión
Conclusiones
El experimento, nos pudo explicar y mostrar el consumo de oxigenó, como nos dice la teoría de la combustión, es muy importante entender la importancia que aún tiene la combustión en nuestra sociedad actual y que aunque hoy día la ciencia ya tiene entendida es verdad que esta siempre esta buscando la forma de hacerla más eficiente y reducir la emisión de gases de efecto invernadero, pero la combustión esta con nosotros por muchos, muchos años más.
Bibliografía
ING. JOSE G BLANCAS GARCIA
Ciencia para niños
http://www.investigacionesyciencia.es.
http//HTML.Rincóndelvago.com
http://profesoresenlínea.com
La combustión
La combustión
Summary
Research Question
Problem approach
Background
Objective
Justification
Hypothesis
Method (materials and procedure)
Method Gallery
Results
Results Gallery
Discussion
Conclusions
Bibliography